中心在海洋粘附蛋白仿生材料研究领域取得重要进展
近日,中国海洋大学方宗熙海洋生物进化与发育研究中心刘伟治教授团队在ACS Nano发表研究论文“Extracellular Matrix-Mimetic Intrinsic Versatile Coating Derived from Marine Adhesive Protein Promotes Diabetic Wound Healing through Regulating the Microenvironment”(海洋粘附蛋白来源的类细胞外基质涂层通过调节微环境促进糖尿病足创面愈合)。该论文报道了国际上首个以扇贝粘附蛋白为主要成分制备的仿生材料用来治疗难愈合创面,于多个糖尿病动物模型中均表现出强大的促愈合能力,大大优于市售产品生长因子和纳米银凝胶,并详细探究其促愈合作用机制。上述成果是团队长期践行的从海洋粘附蛋白仿生材料向生物医学转化理念的重要体现。
糖尿病足溃疡(Diabetic foot ulcers, DFUs)是糖尿病严重并发症之一,作为典型的难愈合伤口具有极高的患病率和致残率。创面的持续渗出导致湿粘附性较差的敷料降解,药物分子无法在创面处稳定发挥作用,进而致使50%的创面未得到有效护理。同时,在高糖环境下伤口反复感染,无法实现从炎症期到增殖期的转变。因此,迫切需要制备兼具湿粘附性和多功能性的敷料,以应对慢性创面修复过程中的种种挑战。
受海洋粘附启发,研究团队在扇贝足丝蛋白中定位到一种由表皮生长因子结构域组成的关键蛋白,在Ca2+的诱导下发生自组装,快速形成由纳米粒层层堆积的类细胞外基质涂层材料。该蛋白涂层制备时间短(30min,在蛋白基涂层中最短),原位吸附,绿色无毒,代表了一类新型非Dopa依赖组装模式。
扇贝足丝蛋白涂层具有优异的湿吸附性,独特的力学性能,以及卓越的抗氧化性。经过工程化改造的扇贝足丝蛋白涂层可改善抗菌肽毒性,并通过接触抑制和降解释放两种模式抑制革兰氏阳性菌和革兰氏阴性菌生长。凭借上述特性,该涂层在糖尿病小鼠、糖尿病兔子以及离体培养的人皮模型中均表现出优于市售产品的伤口促愈合活性,成为一种治疗慢性伤口的新材料。
通过对创面促愈合机制的探究,发现扇贝足丝蛋白涂层可以有效调节创面微环境:(i)促进巨噬细胞极化;(ii)调节炎症细胞因子活动,抑制相关基因表达;(iii)诱导血管再生;(iv)加速ECM重塑。该新型类细胞外基质涂层为难愈合创面的临床治疗开辟了新途径,且工程化改造的成功经验将指导未来多功能涂层敷料的设计,使扇贝足丝蛋白化身为“超级英雄”。
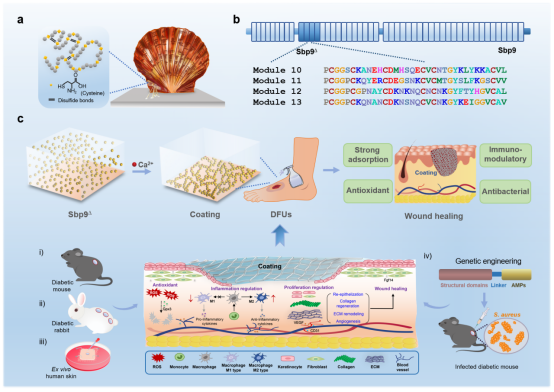
图1. 扇贝足丝蛋白涂层在难愈合创面修复中的应用。
a,b) 基于扇贝足丝关键粘附蛋白Sbp9的发现;c) 涂层组装机制及创面促愈合活性探究。
中国海洋大学方宗熙海洋生物进化与发育研究中心刘伟治教授为论文唯一通讯作者,博士生王露露和薛波为论文共同第一作者。青岛市内分泌糖尿病医院为该研究提供了珍贵样品和宝贵临床经验,中国海洋大学以及华东师范大学多位老师参与了论文研究工作。该工作得到国家自然科学基金等项目资助。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.4c03626
相关论文:
1. Zhang, X., et al. (2022). Extensible and self-recoverable proteinaceous materials derived from scallop byssal thread. Nat Commun, 13(1):2731.
2. Wang, L., et al (2022). Exploration of sea anemone-inspired high-performance biomaterials with enhanced antioxidant activity. Bioact Mater, 10: 504-514.
3. Xia, Y., et al. (2024). The design of an RGD in situ sustained delivery system utilizing scallop byssal protein through genetic engineering. Int J Biol Macromol, 267:131636.


 English
English 中文
中文

