王玮课题组在EMBO JOURNAL发文,揭示心脏早期发育关键调控机制
2025年11月3日,中国海洋大学方宗熙海洋生物进化与发育研究中心王玮教授团队与挪威卑尔根大学Lionel Christiaen教授团队合作,在国际权威期刊《EMBO JOURNAL》以长篇研究论文形式在线发表了题为“Cell cycle-driven transcriptome maturation confers multilineage competence to cardiopharyngeal progenitors”的最新研究成果。研究以演化关键节点动物海鞘为模型,凭借其清晰的细胞谱系,整合高时空分辨率单细胞组学与基因编辑-验证技术体系,系统揭示了细胞周期驱动心脏前体细胞多能性建立的调控机制。文章首次在转录调控层面定义了“成熟”状态的心脏前体细胞,并解析了此状态对于早期心脏发育的生物学意义。
在发育过程中,多能前体细胞如何经由命运决定产生不同类型的细胞,是生命科学的核心问题。本研究发现心脏多能前体细胞在命运决定事件前会经历一个关键的“能力获得窗口期”——此时细胞虽未分化,但已具备了产生不同后代细胞的能力。研究团队将这一过程定义为“转录水平成熟”,并鉴定出其中关键的“成熟基因”。进一步机制研究表明,这一过程由经典的基因调控网络与细胞周期(G1-S期转换)共同驱动,确保了谱系特异性发育程序的准时启动。
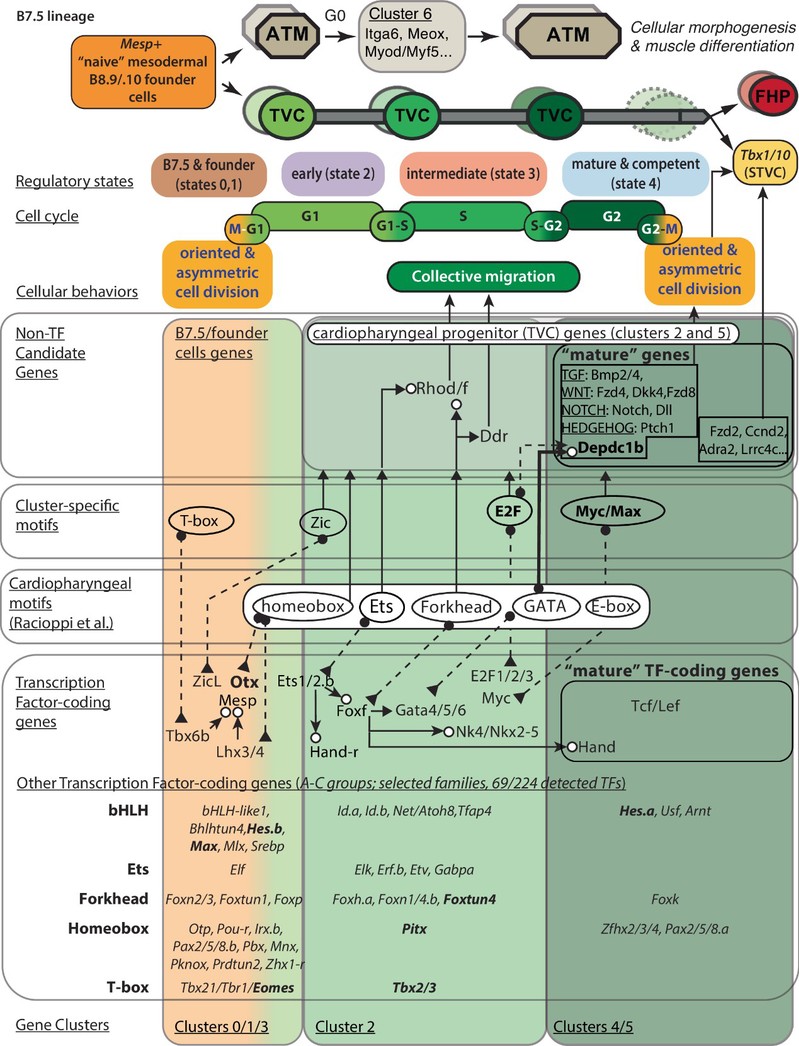
海鞘作为脊索动物演化中的关键节点,其心脏早期发育的核心调控机制与脊椎动物高度保守,是探究心脏发育与演化的理想模型。基于这一模型,王玮教授已在心脏早期发育调控领域取得了一系列重要发现,成果相继发表于 Nature Cell Biology、PLOS Biology、Developmental Cell、 Nature Communications等国际权威期刊。本项研究作为该系列工作的最新突破,首次绘制了心脏早期发育的“转录调控蓝图”,这一里程碑式的成果,为从演化与发育的视角深入解析心脏的起源与构建奠定了坚实理论基础。
中国海洋大学方宗熙海洋生物进化与发育研究中心王玮教授和挪威卑尔根大学Lionel Christiaen教授为本文的共同通讯作者,中心博士研究生张萍在关键基因调控机制验证中做出了重要贡献。研究工作得到了国家自然科学基金项目资助。
原文链接:https://www.embopress.org/doi/full/10.1038/s44318-025-00613-y


 English
English 中文
中文

