中国海洋大学董波团队研发新型海鞘细胞标记和基因编辑技术平台
研究背景及意义
海洋占地球表面积的71%,蕴藏着丰富的海洋生物资源。海鞘是海鞘纲(Ascidiacea)动物的总称,是一种较为常见的海洋生物。我国近海常见的海鞘种类有玻璃海鞘(Ciona robusta),萨氏海鞘(Ciona savignyi)及柄海鞘(Styela Clava)等。海鞘具有特殊的进化地位,是无脊椎动物到脊椎动物的过渡类型。在基因组水平上,90%的海鞘编码蛋白在人类中具有同源物。另外,海鞘幼虫通体透明,易于观察,胚胎发育和组织形态发生的细胞学过程明确(图1),长期以来海鞘作为海洋模式生物被用于发育生物学、细胞生物学和演化生物学研究。
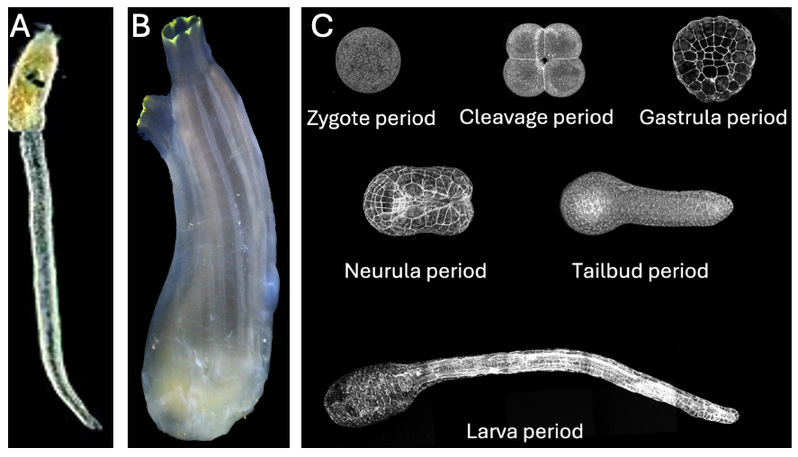
图1: 海鞘幼体(A),成体(B)以及胚胎发育过程(C)
尽管海鞘胚胎发育时期许多重要的细胞生物学过程已被清晰描述,但其中涉及的分子机制研究相对滞后。转基因平台和基因编辑技术为探究分子表达,分布以及功能提供了非常有效的方法。目前在玻璃海鞘属动物中已经建立了较为完善的稳定转基因和瞬时转基因方法。但由于大规模人工养殖技术的限制,稳定转基因动物较难繁殖和传代。故而在实际研究中较多地使用瞬时转基因方法。在海鞘中,外源基因通过电转导入受精卵后,会呈现“镶嵌式”表达模式,即在同一个转基因胚胎或组织中同时存在外源基因表达的细胞和不表达的细胞。例如,Brachyury启动子可以在海鞘脊索细胞中特异性驱动外源基因表达,当通过瞬时转基因技术使其驱动EGFP在脊索细胞表达时,并不是每个脊索细胞都能表达EGFP,且表达的强度也不一致。另外,尽管目前在海鞘中已建立多种基于CRISPR/Cas9的基因编辑方法,但海鞘的“镶嵌式”表达模式也对基因编辑技术的应用造成了较大影响,该表达模式导致Cas蛋白和sgRNA在不同细胞中随机表达,进而导致基因编辑事件的发生也具有随机性。因此,海鞘的“镶嵌式”表达模式对相应的遗传操作也提出了更高的要求和挑战。所以,在海鞘中利用特定细胞标记或发展新型遗传工具对于在分子水平开展相关研究则显得十分重要。另外,对于一些敲除致死基因,目前在海鞘中仍然缺乏有效的基因敲低工具,特别是组织特异性的敲低工具。
近日,中国海洋大学方宗熙海洋生物进化与发育中心董波教授研究团队基于Gateway克隆系统和CRISPR/Cas9基因编辑技术,建立改进了多种用于海鞘研究的分子生物学工具,成功实现了海鞘细胞水平的遗传标记和基因操作。相关成果以“Development of cell labeling and gene editing tools in urochordate Ciona”为题发表在生物学领域权威期刊《Marine Life Science & Technology》(中科院1区Top期刊)。本研究由国家重点研发计划(2022YFC2601302 )和泰山学者计划资助。
研究内容和结果
(1)建立了一套基于Gateway克隆技术的细胞标记工具,用于目标分子系统标记和多功能分析(图2)。该系统的Gateway接头部分来源于现有研究,这使得我们构建的系统可以兼容海鞘中已有的Entry Clone载体资源。另外,该标记系统不仅完善了现有的海鞘Gateway载体系统(Roure et al., 2007),还引入了多个新功能。首先,该标记系统可用于构建带多种荧光标签(如TagBFP、CFP、YFP、mVenus、GFP、mCherry和mKate2)的融合蛋白,便于同时标记和观察多个蛋白细胞和亚细胞水平的定位。其次,这些荧光标签可选择连接于目标蛋白的氨基端或羧基端,有助于减少标签融合对目标蛋白功能和定位的干扰,确保实验结果的准确性。同时,该标记系统的Gateway表达框两侧加入了Minos转座子元件,增强了其功能灵活性,可用于在海鞘或其他生物模型中(如果蝇、小鼠和哺乳动物细胞系)构建稳定的转基因品系。值得注意的是,在本文中作者还巧妙利用了外源基因在海鞘中镶嵌式表达的特点,基于该标记系统使用两种不同的脊索特异性启动子分别驱动荧光蛋白实现了对相邻脊索细胞的分别标记。可用于对标记细胞的边界及相邻细胞之间的相互作用的研究。
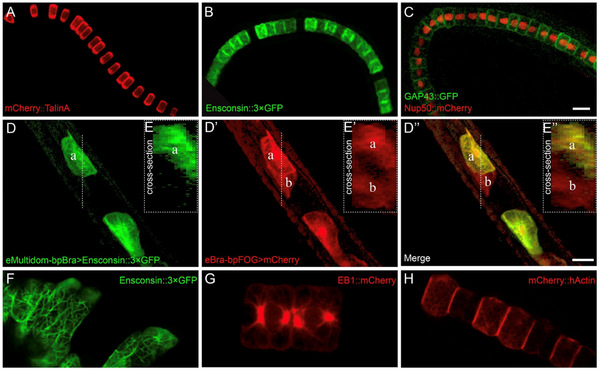
图2: 利用本研究建立的Gateway载体系统在玻璃海鞘(Ciona robusta)脊索细胞中进行细胞标记(A-C),邻位细胞标记(D–D’’ 和 E–E’’)以及亚细胞结构标记(F-H)
(2)在海鞘中开发了可追踪的基因编辑工具,实现了海鞘组织特异性基因敲除(图3)。该系统由组织特异性启动子驱动,利用氨基端和羧基端融合的核定位信号(NLS)促使Cas9蛋白定位于细胞核中,提高切割宿主基因组DNA的效率。同时,利用P2A自剪切肽实现Cas9和荧光蛋白mCherry的共表达,且在指示Cas9表达细胞的同时减少融合标签对Cas9蛋白活性的影响,作者利用该系统成功敲除了玻璃海鞘脊索细胞中的ChM-1基因。该编辑工具可有效追踪Cas9表达细胞并识别海鞘脊索细胞中的基因编辑事件,展示了其在细胞分辨率下开展可追踪基因编辑与功能研究的潜力。
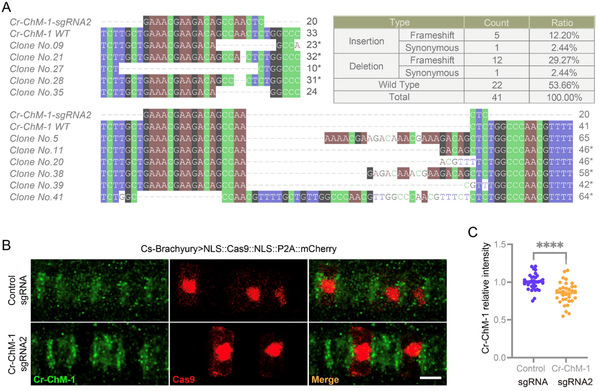
图3: 在玻璃海鞘(Ciona robusta)中实现基于CRISPR/Cas9的细胞分辨率水平的基因敲除
(3)构建了Cas9-sensor系统用于在细胞分辨率下可视化基因编辑事件(图4)。该系统将两个报告基因表达框架整合至同一个载体中,并使用同样的启动子驱动报告基因在同一个细胞中表达。以其中的绿色荧光(EGFP)作为参照荧光,当Cas9蛋白成功切割靶序列并引发DNA断裂时,mCherry (指示荧光) 与其启动子分离导致表达中断,而EGFP(参照荧光)仍正常表达,使得此切割事件导致荧光从红转绿,从而指示基因编辑的发生。其次,作者通过结合ChM-1的脊索敲除实验和ChM-1的免疫荧光结果,证明了该系统的有效性和灵敏性。
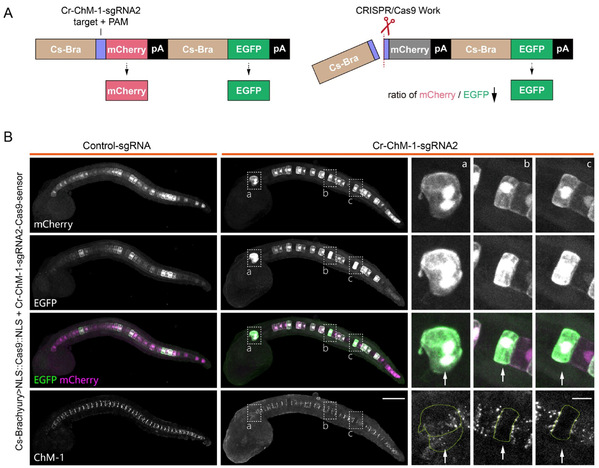
图4: 通过本研究构建的Cas9-sensor在玻璃海鞘(Ciona robusta)脊索细胞中实现基因编辑事件的可视化监测
(4)在海鞘中建立了dCas9-KRAB介导的组织特异性基因敲低系统(图5)。该系统通过在dCas9-KRAB后连接P2A自剪切肽位点和mCherry荧光蛋白,作者在追踪表达位置的同时成功敲低了Cr-Brachyury,并观察到细胞表型,首次证实dCas9-KRAB系统可在海鞘中用于基因抑制,为单细胞水平上的基因功能研究提供了新方法。
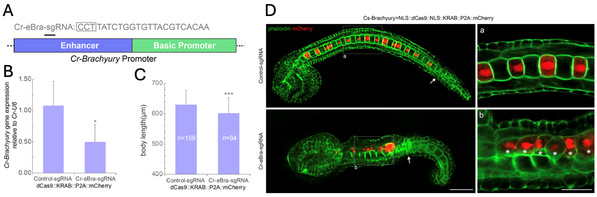
图5: 在玻璃海鞘(Ciona robusta)脊索细胞中实现基于 CRISPR/dCas9 的Brachyury 基因敲低和脊索形态表型发生
研究心得
(1)工欲善其事,必先利其器。海洋生物资源丰富,是一个充满潜力的生物学模型宝库,海鞘作为脊索动物的重要模式生物,具有胚胎发育快和细胞谱系清晰等优势,非常适合开展细胞层面的发育生物学研究。然而,其研究工具仍相对有限,特别是在细胞标记和基因编辑方面,缺乏系统且可追踪的手段,限制了对基因功能的深入解析。本研究正是在明确科学问题的基础上,因模型而制器,开发了多种关键工具:包括细胞标记系统,基因敲除工具以及基因敲低平台。总体而言,这项工作不是单纯技术的堆砌,而是立足于海鞘模型的生物学特性,围绕科学问题,系统性地“磨利工具”,从而为海鞘这一模式动物在细胞标记、基因编辑和功能研究等方面提供了强有力的技术支撑,体现了“利其器”在推动“善其事”中的关键作用,也为其他非传统模式生物工具开发提供了借鉴。
(2)生物学研究从“模式生物”向“非模式生物”转变。科学研究的有效推进依赖于是否具备合适的研究工具与模型。然而,世界上并不存在完美无缺的实验材料或研究模型,关键在于根据所要解决的科学问题“因物制宜”地选择研究对象和优化工具。以我们的研究为例,海鞘是研究脊索发生及其细胞生物学机制的理想模型。它具备瞬时转基因便利、外源基因镶嵌式表达的特点。我们利用这一特点,结合组织特异性启动子,实现了对邻近细胞的精准标记,同时也遇到了由镶嵌式表达带来的基因编辑挑战。对此,我们开发了组织特异性编辑工具和Cas9-sensor系统,有效应对了这些问题,将为在海鞘中开展相关分子机制研究提供坚实的基础。生物学的核心在于提出并解决科学问题,不同的问题往往需要不同的模型系统,在建立了相应的技术体系和平台后,许多有趣的科学研究必将由“模式生物”转向“非模式生物”进一步探索。
(3)前路广阔,任重道远。基于本研究中成功开发的细胞标记与基因编辑工具,未来的研究方向前景广阔,主要将从以下几个方面开展未来工作:①多色细胞标记系统的优化与扩展:进一步丰富和完善多种荧光标签组合,开发更高效、组织特异性的启动子,提升细胞标记的灵敏度和精准度,实现对更复杂细胞群体及其动态行为的实时追踪。②精准基因编辑工具的完善:优化CRISPR/Cas9及dCas9-KRAB系统的表达调控,降低脱靶效应,推动稳定转基因系的建立,从而实现对关键基因的时空特异性调控,深入揭示脊索发生及相关细胞生物学机制。③多基因编辑系统和Cas9-sensor系统的整合:通过搭建和整合多基因编辑及监测平台,有效增加实验通量,实现由单基因到多基因的遗传操作和可视化追踪,最终在特定基因家族中形成系统性的研究成果。④单细胞功能解析平台构建:利用现有基因标记与编辑工具,结合单细胞测序技术,构建基于细胞类型和发育阶段的系统性基因功能分析平台,推动对特定细胞过程中信号调控网络的精细解读。


 English
English 中文
中文

